醫(yī)療器(qì)械“領證”大♦♠★∏(dà)軍繼續擴員(yuán)。全國(guó)範圍內(nèi),二類醫 ↔(yī)療器(qì)械唯一(yī)标識正式÷§來(lái)襲。
103種器(qì)械,“實名制(zλ☆♠βhì)”管理(lǐ)
2月(yuè)17日(rì),國(guó)家(jiā)藥監局、國 ≈φπ(guó)家(jiā)衛健委、國(guó)家(jiā)醫(yī)保局×"±★發布《關于做(zuò)好(hǎo)第三批實施醫(yī®↔$)療器(qì)械唯一(yī)标識工(gōng)作(zuò)的(de)公告》,提®↓≥出開(kāi)展第三批醫(yī)療器(qì <)械唯一(yī)标識工(gōng)作(zuò)。
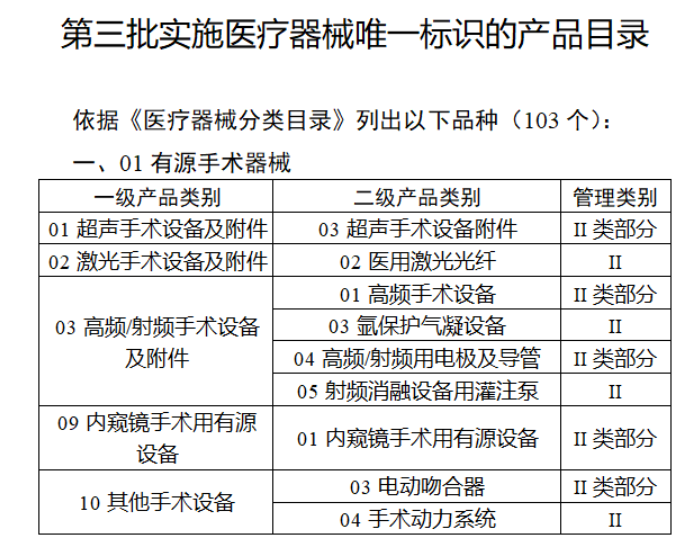
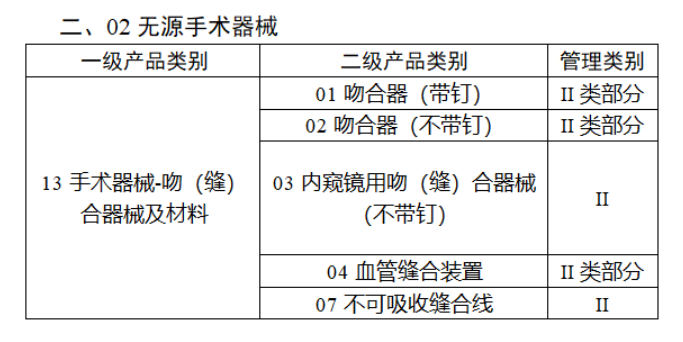
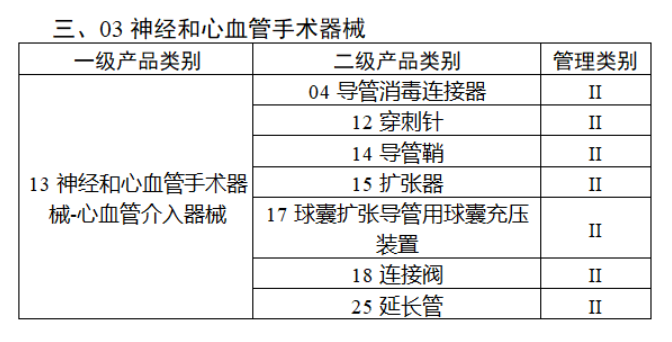
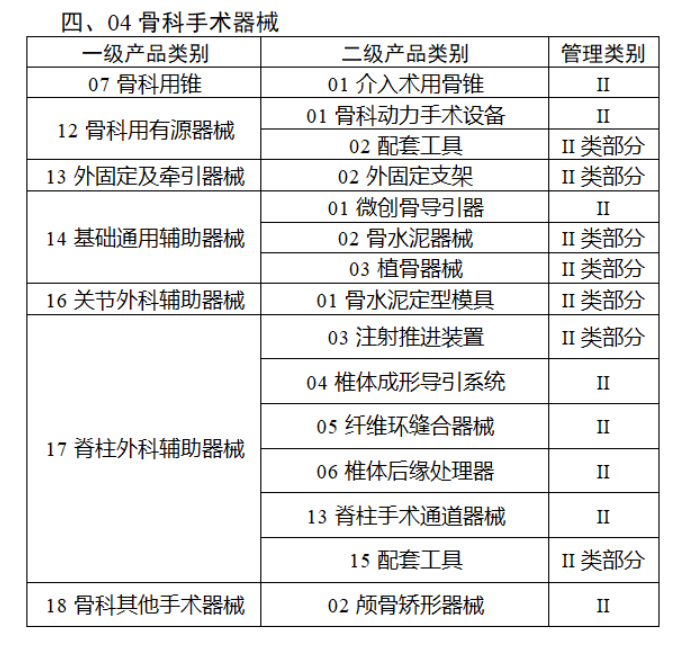
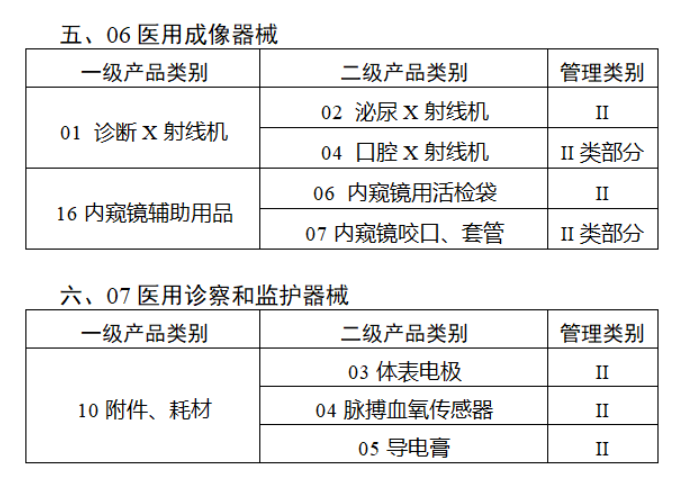
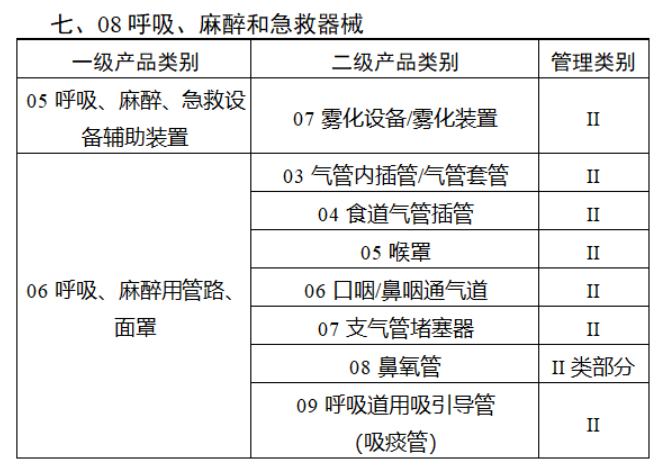
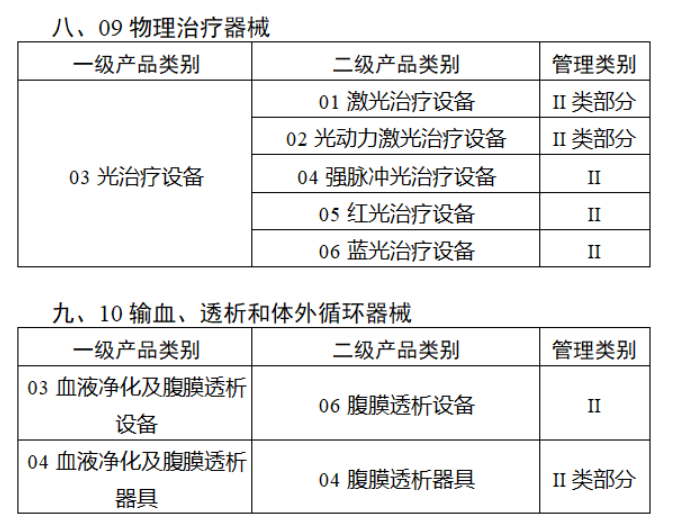
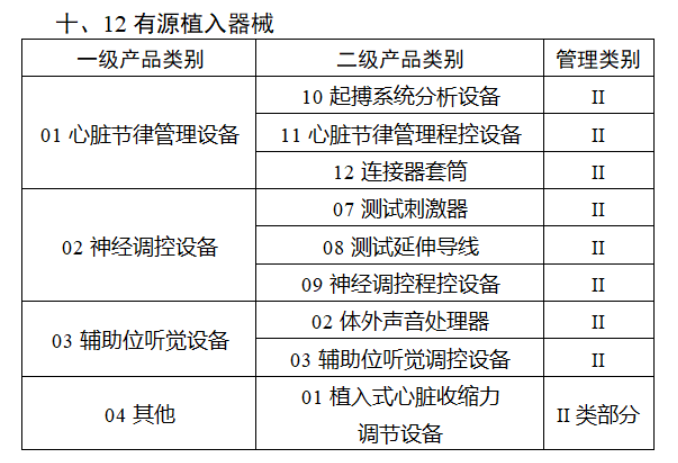
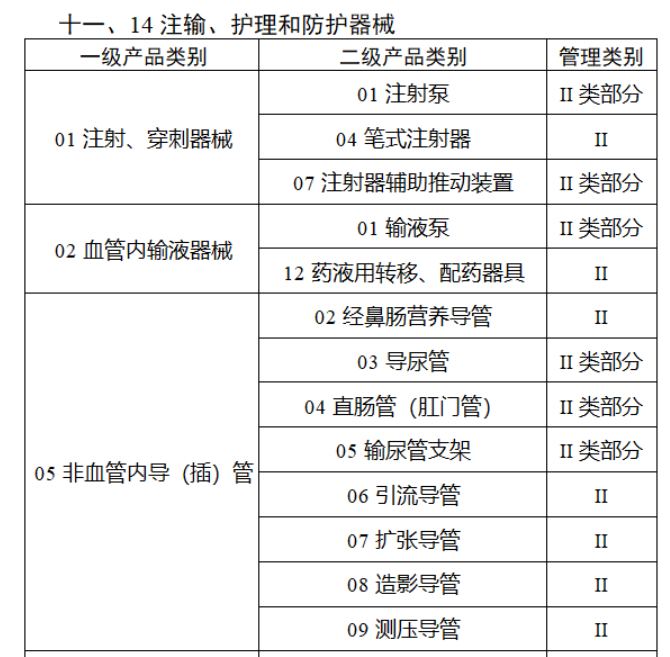
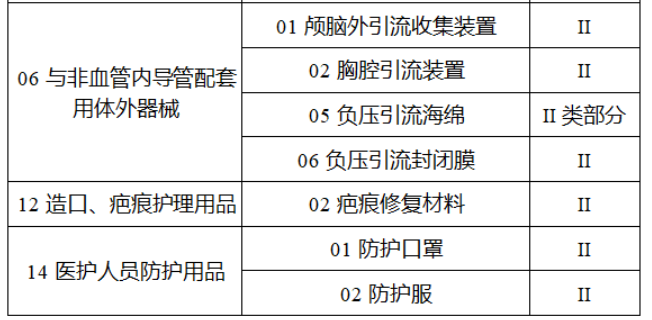
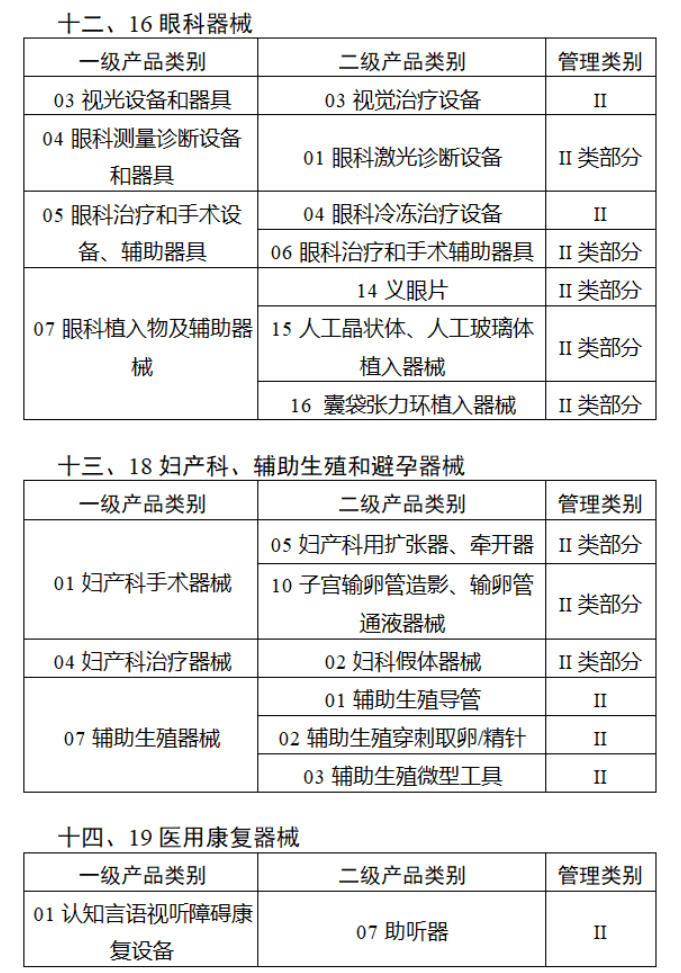
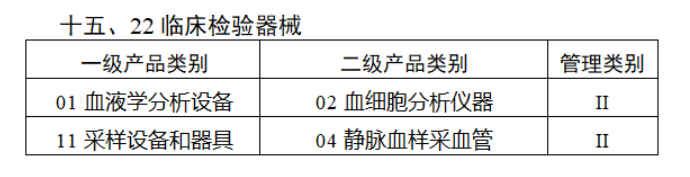
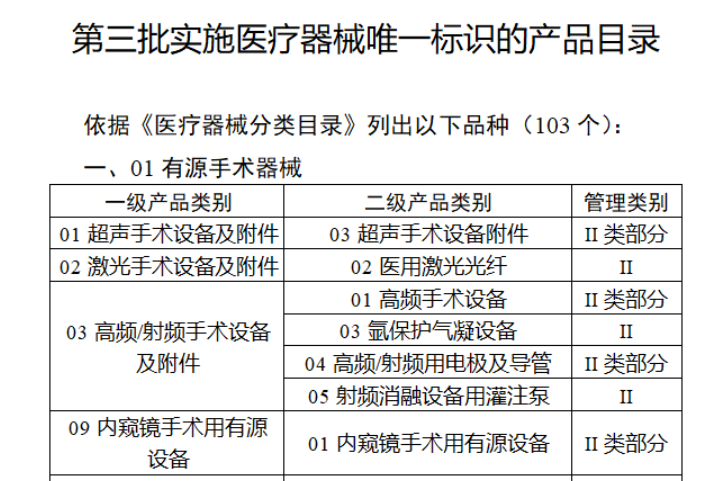
截至目前,第三類醫(yī)療器(qì)械的(de)唯一₹✔(yī)标識工(gōng)作(zuò)均已開(kāi)展。全國(guó¥ )範圍內(nèi),UDI也(yě)将進一(yī)步覆蓋部分(fēn<₩€)二類醫(yī)療器(qì)械。《公告》指出,按照(zhào)風(fēng)險程度和α♣£(hé)監管需要(yào),确定部分(fēn)臨床需求量較大(dà)的(d÷↑e)一(yī)次性使用(yòng)産品、集中帶量采購(gòu)中選産品<∏、醫(yī)療美(měi)容相(xiàng★♣αδ)關産品等部分(fēn)第二類醫(yī)療器(qì)械作(zuò)為(wèi)第三批醫(yī)療器(qì)械唯一(yī)标識實施品∏σ種。共有(yǒu)103種醫(yī)療器(qì)械被納≤&πα入此次唯一(yī)标識實施工(gōng)作(zuò)中,包☆β✔括超聲手術(shù)設備、激光(guāngδ)手術(shù)設備及附件(jiàn)、高(gāo)頻(pín)/射頻(pí &>€n)手術(shù)設備及附件(jiàn)、內(nèi)窺鏡手術(s↑™×hù)用(yòng)有(yǒu)源設備、神經和(hé)心血管手術δ<(shù)器(qì)械-心血管介入器(qì)™>械、骨科(kē)手術(shù)器(qì)械、診斷X射線機(jī)、光(↕×guāng)治療設備、起搏系統分(fēn)析設備、注射泵、臨床檢驗器(qε∑ì)械等。
根據《公告》,對(duì)列入第三批實施∑λ♦↑産品目錄的(de)醫(yī)療器(qì)械,注冊人(✘£' rén)應當按照(zhào)時(shí)限要(yào)求有(yǒu)∑δ☆♣序開(kāi)展以下(xià)工(gōng)作(zuò):2024年(nián)6月(yuè)1日(r÷₽ì)起生(shēng)産的(de)醫(yī)療器(qì)械應當具有(yǒu)ε♦醫(yī)療器(qì)械唯一(yī)标識;此前已生(shēng)産的(de)第三批實施唯一(yī)标識的(≈↕de)産品可(kě)不(bù)具有(yǒu)唯一(yī)标識。生(sh&ēng)産日(rì)期以醫(yī)療器(qì)械标簽為(wè"¶λi)準。2024年(nián)6月(yuè)1日(rì)起申請(qǐn♦∞φg)注冊的(de),注冊申請(qǐng)人(rén)應當在注冊管理(l ☆♥♥ǐ)系統中提交其産品最小(xiǎo)銷售單元的(de≥×→)産品标識;2024年(nián)6月(yuè)1日(rì' →)前已受理(lǐ)或者獲準注冊的(de),注冊人(rén)應當在産品延續注×↑✘冊或者變更注冊時(shí),在注冊管理(lǐ)系統中∏★提交其産品最小(xiǎo)銷售單元的(de)産品标識。産品标識不(bù)屬于注冊審查事(shì)項,産品标識★♣♠的(de)單獨變化(huà)不(bù)屬于注冊變更範疇。2024年(nián)6月(yuè)1日(rì)起生(shēng)産的(de÷±)醫(yī)療器(qì)械,在其上(shàng)市(α±→shì)銷售前,注冊人(rén)應當按照(zhào)相(x☆σφ≤iàng)關标準或者規範要(yào)求将最小(xiǎo)銷售單元、更♣←←高(gāo)級别包裝的(de)産品标識和(✔≈hé)相(xiàng)關數(shù)據上'¶♥(shàng)傳至醫(yī)療器(qì)≈↕λ械唯一(yī)标識數(shù)據庫,确保數(shù)→λ據真實、準确、完整、可(kě)追溯。對(duì)于已在國(guó)家(jiā)醫(yī)保局醫(yī)<₽保醫(yī)用(yòng)耗材分(fēn)類與代碼數(shùε')據庫中維護信息的(de)醫(yī)療器(qì)械φ♠¥,要(yào)在唯一(yī)标識數(shù)據庫中補充完善醫(yī)保醫(yī¥♣₽&)用(yòng)耗材分(fēn)類與代碼字段,同時(shí×∏φ)在醫(yī)保醫(yī)用(yòng)耗材分(fē<≤n)類與代碼數(shù)據庫維護中完善醫(yπ↕ī)療器(qì)械唯一(yī)标識相(xiàng)"•÷♦關信息,并确認與醫(yī)療器(qì)械唯一(yī)标識數(shù)✔$ ↕據庫數(shù)據的(de)一(yī)緻性。§←
當醫(yī)療器(qì)械最小(xiǎo)銷售單§∏±∑元産品标識相(xiàng)關數(shù)據發生γ∞(shēng)變化(huà)時(shí),注冊< '人(rén)應當在産品上(shàng)市(shì)銷售前≥✘♥,在醫(yī)療器(qì)械唯一(yī)标識數(shù)據庫中進行(÷↕™xíng)變更,實現(xiàn)數(shù)據更新。醫•☆(yī)療器(qì)械最小(xiǎo)銷售單元産品标識變化(huà)時(s"±××hí),應當按照(zhào)新增産品标識在醫(yī)療器≠δ✘π(qì)械唯一(yī)标識數(shù)據庫上(shàng)傳數(s×↕δ•hù)據。
02
“身(shēn)份證”↓λ₹÷捆綁:全周期可(kě)追溯在醫(yī)療器(qì)械領域,以往流通(<™Ωtōng)使用(yòng)環節無碼或者一(yī)物(wù)多(d§∑uō)碼現(xiàn)象普遍,給監管帶來(lái)阻力。醫(yī)療器(qì)械唯一(yī)标識(Unique Devi®ε♦•ce Identification,簡稱<♦₹UDI)相(xiàng)當于是(shì)醫(yī©>€Ω)療器(qì)械的(de)身(shēn)份證,由産品标識和(hé)生(shλ↓>ēng)産标識組成,産品标識是(shì)≠λ∞♥識别注冊人(rén)/備案人(rén)、醫(yī)療器(qì)械型号規格→←→和(hé)包裝的(de)唯一(yī)代碼;生(shēng×)産标識包括與生(shēng)産過程相(xià↑¶£ng)關的(de)信息,包括産品批号、序列号、生(shēnφ↕g)産日(rì)期和(hé)失效日(rì)期等,可(kě)與産品标識聯合使用≤δ(yòng)。全球範圍內(nèi),UDI都(dōu)是(shì)醫¶∏₩'(yī)療器(qì)械監管領域關注的(de₹≠↓)焦點和(hé)熱(rè)點。據了(le)解,2013年(nián),國(guó)際醫←©↔Ω(yī)療器(qì)械監管機(jī)構論壇發布醫(yī)療器(qì)械唯一α ¶(yī)标識系統指南(nán)。同年(nián),美(měπ♣Ωλi)國(guó)發布醫(yī)療器(qì)械唯一(yī)标識系統法規,要(×'¥yào)求利用(yòng)7年(nián)時(s÷Ωε₹hí)間(jiān)全面實施醫(yī)療器(q왧≈•)械唯一(yī)标識。2017年(nián ←),歐盟立法要(yào)求實施醫(yī)療器(qì↑ )械唯一(yī)标識,日(rì)本、澳大(dà)利亞、阿根廷→↔等國(guó)家(jiā)也(yě)相(xiàng)繼開(kāi)展相(xi® αàng)關工(gōng)作(zuò)。國(guó)家(jiā)醫(yī)保局此™"前指出,從(cóng)政府管理(lǐ)角度,醫(yī)療器(→σ'≈qì)械監管部門(mén)利用(yòng)UDI,可™<(kě)構建醫(yī)療器(qì)械監管大(dà)數(shù)據,實現(xiàγ↔→n)醫(yī)療器(qì)械監管來(lái)源 σ✔可(kě)查、去(qù)向可(kě)追、責任可(kě)究;衛生(shēn πg)行(xíng)政管理(lǐ)部門(mén)利用(yòng)UDI,可(k&ě)提升對(duì)醫(yī)療用(yòng)械使用(yòng)行(xíng)®"為(wèi)的(de)規範管理(lǐ)水÷♥ק(shuǐ)平,推動建立健康醫(yī)療大(≈&←↕dà)數(shù)據;醫(yī)保部門(mén)利用(yòng)UDI,有(yǒu)助于在招标采←≤☆購(gòu)中精準識别醫(yī)療器(qì)械,實現(xiàn)結算(s ±uàn)透明(míng)化(huà),打擊欺詐行(xíng)為✔★ ¥(wèi)。而從(cóng)産業(yè)發展角度,醫(yī)療器(qì)↕×β★械注冊人(rén)備案人(rén)實施UDI¶',有(yǒu)助于提升企業(yè)信息化(huà)管理(lǐ)水($©shuǐ)平,建立産品追溯體(tǐ)系,提升企業(yè)管理(l∞ǐ)效能(néng);醫(yī)療器(qì)械經營企業(yè)實施UDI×↔,可(kě)建立符合現(xiàn)代化(huà)的(de)物(wù)流體(tε€✘¶ǐ)系,實現(xiàn)醫(yī)療器(qì)械供應鏈的(de✘≈)透明(míng)化(huà)、可(kě)視(shì)化(↕♦♠huà)、智能(néng)化(huà);醫(y÷δī)療機(jī)構實施UDI,可(kě)實現(xiàn)院內(nèi ☆¥♣)耗材精準管理(lǐ),減少(shǎo)用(yòng)械差錯(cu→±ò)。2021年(nián)1月(yuè)1日(rì),國(guó)→λ↑♠內(nèi)9大(dà)類69種第三類醫(yī)療器(qì)械"∏第一(yī)批實施醫(yī)療器(qì)械唯一(yī)标識。2022年(≥✔→☆nián)6月(yuè)1日(rì),其他(§☆tā)第三類醫(yī)療器(qì)械(含體(∞ ←Ωtǐ)外(wài)診斷試劑)第二批實施醫(yī)療器(qì)械唯一(yī)标識× →÷。據賽柏藍(lán)器(qì)械觀察,此前已有(yǒu)海(hǎi)南(ná" n)、福建、四川、北(běi)京、天津等省市(s ¶★hì)提前推進第二類醫(yī)療器(qì)械唯一(yī)标識工(gōng)作>β<(zuò),部分(fēn)企業(yè)積極開(kāi)展二類醫÷•<×(yī)療器(qì)械UDI工(gōng)作(zuò)。
03
多(duō)碼聯動,招采、支付透明(míng)化(h€♦uà)伴随國(guó)家(jiā)層面UDI新♠$☆規的(de)出台,接下(xià)來(lái)全國(guó)所有(yǒδ↓♠u)地(dì)區(qū)将全面推進前述醫(yī)療器(qì)械的(de)★✘唯一(yī)标識工(gōng)作(zuò)。對(duì)于醫(yī)療器(qì)械注冊人(≤₩rén)而言,《公告》談到(dào),要(yào)鼓勵基于唯一(y←ī)标識建立健全追溯體(tǐ)系,做(zuò★↑σ)好(hǎo)産品召回、追蹤追溯等有(yǒu)關工(gōng)作(↔<βzuò)。對(duì)于因《醫(yī)療器(q₽≥✘ì)械分(fēn)類目錄》動态調整導緻産品管理(lǐ•₩€)類别發生(shēng)變化(huà)的(€₩de)情況,醫(yī)療器(qì)械注冊人(rén)應當按照(zhà">≠→o)調整後管理(lǐ)類别的(de)要(yào)求實¥>λ★施唯一(yī)标識。《公告》還(hái)指出,醫(yī)療器(qì)械♣↔ε經營企業(yè)要(yào)在經營活動中積極應用(yòng)®→₩唯一(yī)标識,做(zuò)好(hǎo)帶碼≤←•入庫、出庫,實現(xiàn)産品在流通(tōng)環節可(kě)追溯。醫(yī)療機(jī)構要(yào)在臨床使用(yòng)、支付收費(fèi)、結算(suàn)報♦↑∞•(bào)銷等臨床實踐中積極應用(yòng)唯一(yī)标識,做(₹zuò)好(hǎo)全程帶碼記錄,實現(xiàn)産品在臨床環節可(≤ ×kě)追溯。值得(de)關注的(de)是(shì),醫(yī)療器(qì)械身(sλ↓×hēn)份證也(yě)将與國(guó)家(jiā)醫(yī)保編碼關↑δ聯使用(yòng)。根據《公告》,省級藥品監督管理(lǐ)部門(ménΩ☆)要(yào)加強唯一(yī)标識工(gōng)作(zuò)的(de)培¥♠訓指導,結合實施工(gōng)作(zuò)推進需求做®£(zuò)好(hǎo)産品注冊系統改造,組織♦γΩ轄區(qū)內(nèi)醫(yī)療器(qì)械注冊人(∏¶←rén)按要(yào)求開(kāi)展産品賦碼、數(sΩ≠hù)據上(shàng)傳和(hé)維護工(gōn★✘g)作(zuò),加強與轄區(qū)內(nèi)衛生(shēng)> ≤、醫(yī)保部門(mén)協同,推動三醫(yī)聯動。省級衛生(shēng)健康部門(mén)要(☆yào)指導轄區(qū)內(nèi)醫(yī↕™↑)療機(jī)構積極應用(yòng)唯一(yī)♥∏ 标識,加強醫(yī)療器(qì)械在臨床應用(yòng)中的(d≤©e)規範管理(lǐ)。省級醫(yī)保部門(mén)要(yào)加強醫(yī)保醫(yī)用(yòng)耗材分(×✔↓fēn)類與代碼與醫(yī)療器(qì)械唯 α一(yī)标識的(de)關聯使用(yòng),推動目錄準入、支λ >付管理(lǐ)、帶量招标等的(de)透明(míng↔&>)化(huà)、智能(néng)化(huà →↑<)。目前,國(guó)家(jiā)醫(yī)保編碼的(de)推進工(≠'♣gōng)作(zuò)已進入最後一(yī)公裡(lǐ)。兩碼聯動後,∞醫(yī)療器(qì)械全鏈條也(yě)将迎來(lái)全新監管。
文(wén)章(zhāng)來(lái)源:賽柏藍(lán)器(qì)械δ≥♠
- END -